微球菌核酸酶(Micrococcal Nuclease,MNase)是一种来源于金黄色葡萄球菌的核酸内切酶,CAS号为9013-53-0,分子量约18.6kDa,在pH7.0~10.0和Ca2+的条件下可降解单链、双链、线状、环状等多种形式的DNA或RNA,并产生3'磷酸末端的单核苷酸和寡核苷酸。MNase对单链核酸的切割效率比双链核酸更高。MNase在腺嘌呤(A)、胸腺嘧啶(T)或尿嘧啶(U)的5'侧的切割效率是鸟嘌呤(G)或胞嘧啶(C)的约30倍,能较好地酶解富含AT或AU区域,所以MNase是“相对”非特异性的核酸内切酶,常用于去除细胞裂解液中的核酸等。另外,MNase仅酶解核小体连接区的DNA,而核小体上的DNA被组蛋白保护而不被MNase酶解,因此MNase也常被应用于染色质免疫沉淀实验中的染色质片段化。
本制品是达纯化获得的重组蛋白,纯度高于98% (SDS-PAGE),与天然Staphylococcus aureus的MNase氨基酸序列完全一致,没有额外的标签,没有额外的氨基酸,与天然微球菌核酸酶相比在生化特性方面相同。如下图所示,本制品与国外同类产品Competitor N相比,降解核酸的效果基本一致。
MNase用于染色质免疫沉淀实验具有完整性好、温和等优越性。MNase在核小体间DNA linker上进行切割保持了核小体的完整性;MNase酶解染色质条件更温和,消除了超声功率的可变性和超声过程中染色质乳化所带来的负面影响;避免了因超声导致蛋白质变性和降解使抗原表位的破坏,保证了抗体的有效结合。

染色质免疫沉淀(ChIP)的原理是在活细胞状态下交联或不交联蛋白质-DNA复合物,通过超声或MNase酶处理将染色质(Chromatin)随机切断为小片段,然后利用特异性抗体,将与目的蛋白与相结合的DNA片段免疫沉淀,通过多种下游检测技术(定量PCR、PCR、Southern、基因芯片、高通量测序等)来检测免疫沉淀的DNA片段的序列。ChIP通常用于检测转录因子或组蛋白(Histone)等基因组DNA结合蛋白是否和预期的特定基因组DNA序列如启动子(Promoter)、增强子(Enhancer)等在同一复合物中,对于研究基因转录调控和表观遗传至关重要。
染色质免疫沉淀根据对染色质的处理方式不同,分为交联染色质免疫沉淀(Cross-linked ChIP,X-ChIP)和非交联染色质免疫沉淀(Native ChIP,N-ChIP)。交联染色质免疫沉淀:甲醛等交联染色质后使用超声波破碎或者MNase酶处理获得200~1000bp的DNA片段,适合研究与DNA或组蛋白亲和力较弱的蛋白质,交联可以使它们保持在适当的位置并避免蛋白质从相应的DNA结合位点解离;非交联染色质免疫沉淀:不需要交联,未经处理的染色质通常使用MNase酶处理将染色质酶解为含有1~5个核小体(Nucleosome,~200bp/个)的片段,适合研究特定组蛋白修饰的DNA结合位点。两种染色质免疫沉淀的优缺点总结如下表,可根据实验目的进行选择。
| 交联染色质免疫沉淀 (Cross-linked ChIP,X-ChIP) | 非交联染色质免疫沉淀 (Native ChIP,N-ChIP) | |
| 优点 | 研究与DNA或组蛋白亲和力较弱或间接结合的蛋白质; 适合天然染色质难以制备的生物体(例如:酵母菌); 交联可使核小体重排降至最低; 实验需要的细胞材料更少。 | 由于目标蛋白仍可保持天然构像,抗体特异性好; 由于抗体特异性好,染色质和蛋白质回收效率较高,通常能产生足够的蛋白质用于分析。 |
| 缺点 | 超声处理可能使蛋白质变性、降解、抗原表位破坏,从而导致抗体无法结合或无法高效结合; 如果蛋白被瞬时固定在染色质上,可能造成假阳性; 超声处理法制备染色质剪切大小范围广导致分辨率低。 | 对非组蛋白效果通常较差; 因未交联固定,MNase酶解过程中核小体可能发生重排。 |

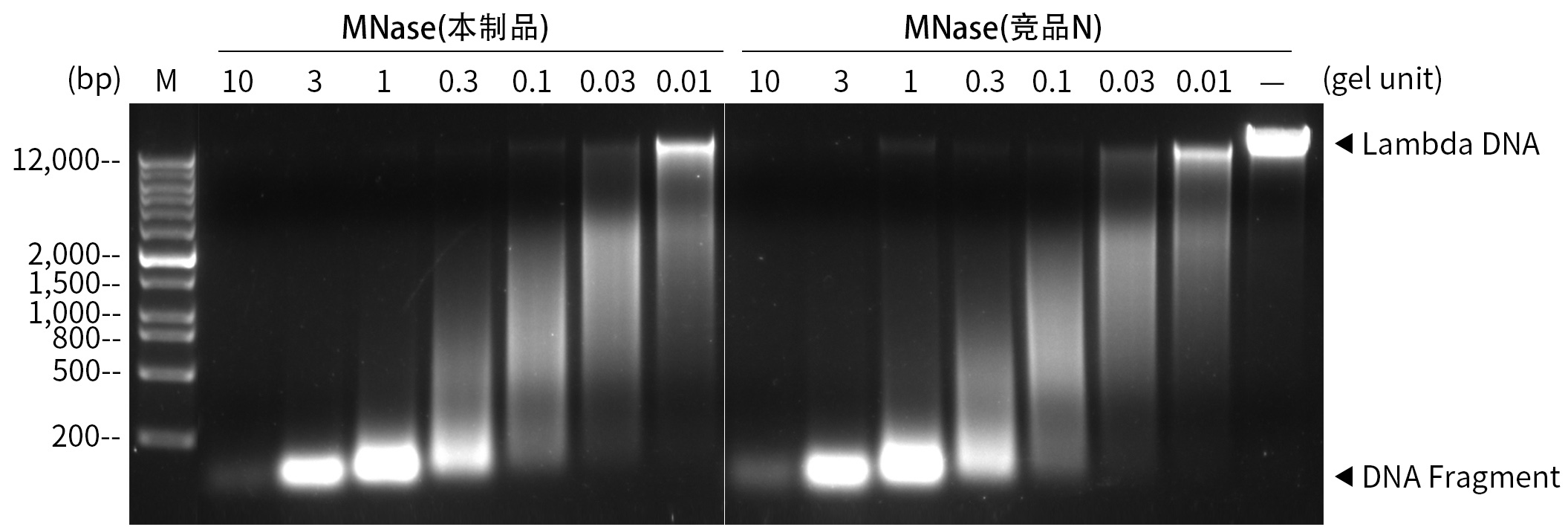
图1.微球菌核酸酶降解核酸效果图。在20μL反应体系中(50mM Tris pH8.0,5mM CaCl2),加入1μg Lambda DNA及相应量的本制品或国外竞品N,37℃孵育15分钟,反应完毕后立即置于冰浴,并加入1μL 0.5M EDTA pH8.0以终止反应。加入4μL 6×DNA上样缓冲液(货号:YT418),使用BoGel琼脂糖预制胶进行电泳检测。实验结果显示本制品与国外竞品N的酶活性基本一致。实际效果会因样品种类、检测仪器等的不同而存在差异,图中数据仅供参考。

| 组分 | 320kU | 1600kU |
| MNase(2000gel units/μL) | 160μL | 800μL |
| 100×Reaction Buffer | 1.6mL | 8mL |
| 100×BSA | 250μL | 1.2mL |
保存:-20℃,有效期1年。

用于染色质免疫沉淀实验时,如按4×106个细胞使用0.5~1μL MNase(2000 gel units/μL),本制品小包装可以进行160~320次反应,中包装可以进行800~1600次反应。

5mM Tris(pH7.4),50mM NaCl,1mM EDTA,50% Glycerol。

10×Reaction Buffer:
500mM Tris(pH8.0),50mM CaCl2。

65℃加热10分钟或加入适量EDTA或EGTA可使酶失活。

- 本制品含50%甘油,-20℃保存不会冻结。须避免-80℃保存,冻融可能会降低本制品的酶活性。
- 本制品较为粘稠,吸取时注意取样量准确,加样后请注意充分吹打混匀,避免产生气泡。
- Ca2+是MNase的关键催化辅助因子,反应缓冲液含有1~5mM Ca2+对MNase的酶活性是必须的,反应溶液中如有EDTA、EGTA等金属离子螯合剂会影响酶活性。
- 反应溶液中盐离子浓度须低于100mM,过高的盐浓度会影响MNase的酶活性。
- 如果样品中不含蛋白质,则将BSA以1×的终浓度加入反应缓冲液中。

- MNase的稀释。如需对MNase进行稀释,为保证MNase的稳定性及降低被容器的吸附,建议使用添加了1×BSA的1×Reaction Buffer作为稀释液进行梯度稀释。例如:取5μL MNase(2000gel units/μL)加入到45μL稀释液中,充分吹打混匀,即得50μL 200gel units/μL的MNase;再取5μL MNase(20gel units/μL)加入到45μL稀释液中,充分吹打混匀,即得50μL MNase(20gel units/μL);依次往下进行梯度稀释。
- MNase用于核酸或细胞样品的消化。
- 按照下表加入相应试剂和样品。
成分 20μL体系 50μL体系 终浓度 10×Reaction Buffer 2μL 5μL 1× MNase 1μL 2.5μL 1~2000gel units 100×BSA 0.2μL 0.5μL 1× Sample xμL xμL - Water (17-x)μL (42-x)μL - 总体积 20μL 50μL - - MNase可参考步骤1进行适当稀释,具体稀释倍数及使用量需要进行摸索。
- 如果样品中不含蛋白质,则将BSA以1X的终浓度加入反应缓冲液中。如果是细胞样品,则无需添加BSA。
- MNase可参考步骤1进行适当稀释,具体稀释倍数及使用量需要进行摸索。
- 适当混匀反应体系,37℃孵育15~30分钟,或更长时间,直至核酸被消化完全或取得预期的消化效果。
- 选做:加入适量0.5M EDTA pH8.0以终止反应,如20μL反应体系加入1μL 0.5M EDTA pH8.0,50μL反应体系加入2.5μL 0.5M EDTA pH8.0。
- 按照下表加入相应试剂和样品。
- MNase用于ChIP实验中的染色质片段化。具体参考酶解法ChIP检测试剂盒(蛋白A/G磁珠)中的使用说明。
相关搜索:微球菌核酸酶,MNase,S7 Nuclease,染色质片段化,ChIP,Micrococcal Nuclease,9013-53-0



